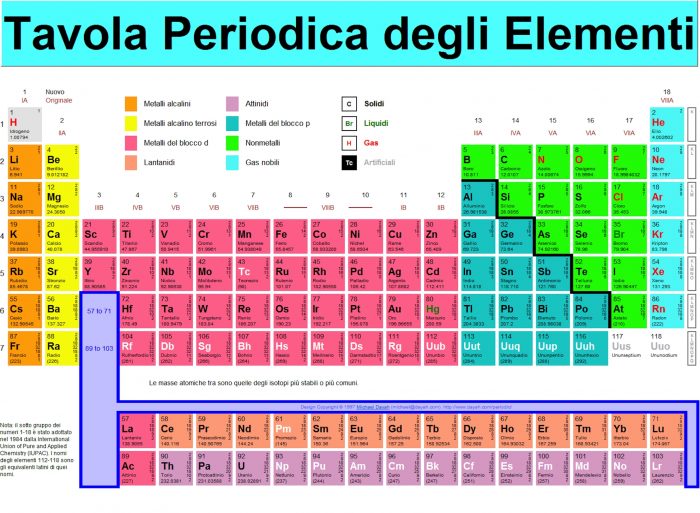
È, ad oggi, il numero degli elementi presenti nella tavola periodica di Mendeleev, o tavola periodica degli elementi o più semplicemente tavola periodica, a cui si ispira Il sistema periodico, uno dei libri più belli scritti da Primo Levi, a cui probabilmente, se non si fosse tolto la vita, ne avrebbe fatto seguito un altro intitolato Il doppio legame.
Dentro c’è tutto quello che costituisce tutto quello che c’è. Racchiude insomma – in 18 colonne (gruppi A e B) e 8 righe (periodi) – le informazioni basilari sugli elementi chimici che costituiscono la materia e di cui è fatta la realtà, eccezion fatta per quanto ad essa noi aggiungiamo con la nostra mente.
 L’ha ideata nel 1869 il chimico russo Dmitrij Ivanovič Mendeleev (1834 – 1907) e all’epoca contava numerosi spazi vuoti, lasciati tali per riempirli nel momento in cui fossero stati scoperti quegli elementi di cui si supponeva l’esistenza ma non se ne sapeva altro.
L’ha ideata nel 1869 il chimico russo Dmitrij Ivanovič Mendeleev (1834 – 1907) e all’epoca contava numerosi spazi vuoti, lasciati tali per riempirli nel momento in cui fossero stati scoperti quegli elementi di cui si supponeva l’esistenza ma non se ne sapeva altro.
Qualcosa di simile, pressoché in contemporanea, l’anno successivo per l’esattezza, lo disegnò un altro chimico, il tedesco Julius Lothar Meyer (1830 – 1895). Mendeleev aveva ordinato gli elementi conosciuti sia in base alla ricorrenza di caratteristiche chimiche simili, che in base alla massa atomica crescente, dando però la precedenza nella creazione della sequenza alla periodicità, cioè al comportamento chimico e non alla massa, proprietà fisica; quando si svilupparono, poi, le teorie della struttura atomica, ci si accorse che egli aveva effettivamente ordinato gli elementi in ordine di numero atomico o carica nucleare crescente.
La sua insomma era più precisa ed appunto lasciava aperta quella possibilità grazie proprio a quei vuoti che, per ora, sono stati colmati il 30 dicembre 2015, quando nella tavola periodica ufficiale sono stati introdotti gli elementi 113, 115, 117 e 118, i cui nomi sono rispettivamente nihonio, moscovio, tennesso e oganesson.

La versione originale, aggiornata da Mendeleev nel 1871, conteneva, per capirsi, l’alluminio (Al), il ferro (Fe), l’ossigeno (O), l’idrogeno (H) e, fatto basilare, il carbonio (C), nonché molto altro ancora, ma ignorava l’esistenza dei “gas nobili” o “rari” come l’elio (He) o il neon (Ne) per i quali fu aggiunta una colonna a destra delle 7 indicate da Mendeleev quando, fra il 1885 e il 1890, questi vennero scoperti.
Solo dopo il 1951, quando all’americano Glenn Seaborg fu conferito il Nobel per la chimica per aver sintetizzato il plutonio, nella tavola periodica furono inserite due righe per i lantanidi e gli attinidi.
La storia di questi inserimenti è affascinante e tiene conto della scoperta di elementi che non esistono in natura o, com’è il caso di qualche elemento transuranico, cioè sia più “pesante” dell’uranio, esistono solo in piccole quantità, sono molto instabili, decadono velocemente, è difficile individuarli e vengono sintetizzati solo in laboratorio. Il primo di essi fu il nettunio, sintetizzato nel 1939.
Ma di molti di questi la tavola periodica di Mendeleev “prediceva” l’esistenza, lasciando spazi che sarebbero stati riempiti in sequenza quando i chimici scoprirono nuovi elementi.